温州医科大学Akon Higuchi教授团队:人源诱导多能干细胞在肽修饰水凝胶培养中向视网膜色素上皮细胞的分化

DOI:https://doi.org/10.1093/rb/rbaf035
摘要 温州医科大学Akon Higuchi教授团队研究成果: 本研究制备了多种新型肽修饰水凝胶,其修饰肽来源于玻连蛋白(PQVTRGDVFTMP)或层粘连蛋白β4链(PMQKMRGDVFSP)。这些肽修饰水凝胶在无异源条件下促进了人源诱导多能干细胞(hiPSCs)的粘附、增殖和集落形成,并将其多能性维持至第5代。我们利用其中一种最适宜的、源于玻连蛋白的无异源肽修饰水凝胶KVN2CK(KGCGGKGG-PQVTRGDVFTMP),成功从hiPSCs分化生成了RPE细胞。通过视网膜下移植,我们将这些hiPSC来源的RPE细胞植入到大鼠视网膜变性模型中,并研究了移植后RCS大鼠的视觉功能改善情况,从而证实了这些细胞的效果。我们新型的肽修饰水凝胶为在无异源条件下生成单层hiPSC来源的RPE细胞提供了一个安全且稳健的平台,这表明这些水凝胶在未来用于治疗视网膜退行性疾病的干细胞疗法中具有潜力。 研究内容简介 一、介绍 视网膜色素上皮(RPE)细胞是一种呈六边形的扁平单层细胞,在维持视网膜稳态和功能方面起着至关重要的作用。RPE功能的退化是导致多种遗传性和非遗传性视网膜退行性疾病(如斯特格特病(SD)和年龄相关性黄斑变性(AMD))的主要因素。AMD是一种进行性且威胁视力的疾病,主要影响老年人,是西方国家不可逆性失明的主要原因。75岁以上人群患早期AMD的风险为25%,而患晚期AMD的风险为8%,由于人口老龄化,预计病例数将会增加。 目前,湿性AMD患者可以通过每月玻璃体腔注射抗血管内皮生长因子(抗VEGF)药物进行治疗。尽管抗VEGF疗法可以延缓部分患者的湿性AMD进展,但长期使用这些药物费用昂贵,并且可能影响RPE细胞的活力及功能。然而,基于人多能干细胞(hPSC)的疗法,即使用人胚胎干细胞(hESC)或人诱导多能干细胞(hiPSC)来源的RPE细胞悬液或RPE细胞片治疗湿性和干性AMD患者,正处于临床试验阶段,并已显示出潜在疗效。 hPSCs主要培养在包被有基质胶、重组层粘连蛋白或玻连蛋白的表面上。基质胶广泛用于hPSC培养,但其来源于小鼠Engelbreth-Holm-Swarm肉瘤。基质胶成分复杂、不明确且可变,这限制了其在基础研究、治疗性细胞生产和基于细胞的分析中的应用。此外,不同批次基质胶的生化性质不一致,降低了细胞实验的可重复性。在开发用于hPSC培养和粘附的无异源且化学成分明确的材料方面已取得重大进展。基质胶通常被人类重组蛋白替代,如人重组层粘连蛋白和人重组玻连蛋白,以支持hPSC的增殖。 近年来,人们越来越关注使用肽来增强用于hPSC培养的合成材料的生物活性。合成肽的应用克服了天然蛋白或全长蛋白的局限性,例如其分子量大、不稳定以及因温度和pH变化而发生的构象改变。合成肽修饰的生物材料能够以高重复性为hPSCs提供粘附位点。Lawley等人开发了名为Synthemax-R和Synthemax II-SC的新型合成肽来支持hPSC培养;这些肽是不含动物成分的共聚物,含有RGD(精氨酸-甘氨酸-天冬氨酸)序列。这些共聚物含有从人类细胞外基质(ECM)蛋白(玻连蛋白)中提取的生物活性肽,并与丙烯酸酯分子共价结合,后者可以包被在组织培养聚苯乙烯(TCP)培养皿上。 在我们之前的研究中,我们设计了几种肽修饰的聚乙烯醇-衣康酸(PAI)共聚物,它们有效促进了hPSCs的增殖。在肽修饰的PAI水凝胶上培养的hPSCs的分化研究目前仅限于中胚层谱系细胞:间充质干细胞和心肌细胞。然而,hPSC在肽修饰的PAI水凝胶上向外胚层谱系细胞(即RPE细胞)的分化尚未被研究,因为大多数hPSC向RPE细胞分化的方案使用的是基质胶包被的培养皿或ECM蛋白。 在本研究中,我们设计并开发了新型PAI水凝胶,其与几种专门设计的肽偶联,旨在维持hPSC增殖并支持其向RPE细胞分化。具体而言,我们研究了几种来源于玻连蛋白(PQVTRGDVFTMP)和层粘连蛋白β4(PMQKMRGDVFSP)的肽的作用,它们可能分别通过αvβ5或α6β1整合素促进hPSC以及hPSC来源的RPE细胞的粘附和增殖。本研究比较了在无异源培养条件下,hiPSC在肽修饰的PAI水凝胶上的增殖和向RPE细胞的分化,与在含异源培养条件下培养在基质胶包被的TCP培养皿上的情况。此外,我们研究了在大鼠视网膜变性模型中,移植在含特定肽修饰PAI水凝胶的无异源细胞培养生物材料上制备的hPSC来源RPE细胞后,其视觉功能改善情况。 二、结果 (一)肽修饰PAI水凝胶的制备与表面表征 先前有报道称,来源于层粘连蛋白β4链(PMQKMRGDVFSP)和玻连蛋白(PQVTRGDVFTMP)的肽能够支持hPSC多能性及其向心肌细胞的分化。本研究选择并优化了这两种已报道的肽序列,通过特定的肽修饰创建了新型肽序列,并评估了这些新型肽在修饰的PAI水凝胶上支持hPSC向RPE细胞分化的效力。本研究中使用的肽包括来源于层粘连蛋白β4链的序列(LB2CK,KLB2CK)和来源于玻连蛋白的序列(VN2CK,KVN2CK),以及1:1混合物LB2CK/VN2CK和KLB2CK/KVN2CK(图1)。KLB2CK在LB2CK的第一个残基处额外添加了一个赖氨酸(K)。KVN2CK在VN2CK的第一个残基处额外添加了一个赖氨酸(K)。我们旨在通过在N端添加赖氨酸(K)来增强hiPSCs对修饰有KLB2CK和KVN2CK的PAI水凝胶表面的粘附能力,因为细胞表面带负电位(静息电位通常约为-70 mV),并将修饰了这种改进肽的水凝胶分别与修饰了LB2CK和VN2CK的水凝胶进行了比较。 图1 肽修饰水凝胶表面的设计。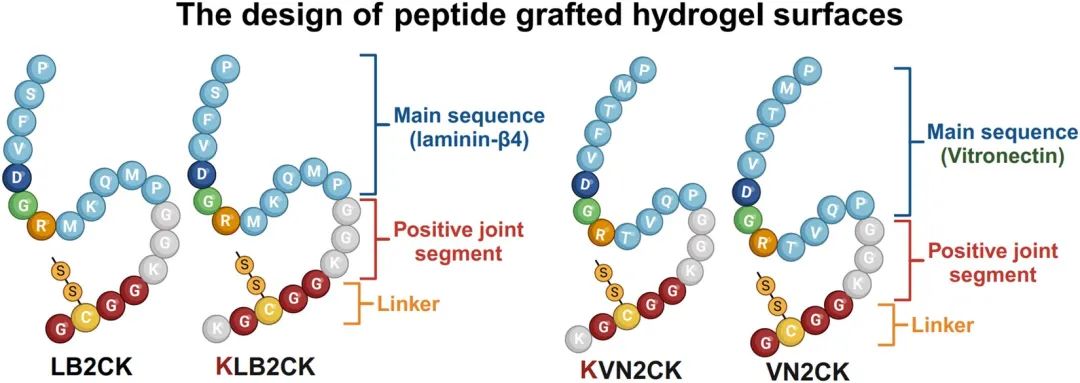
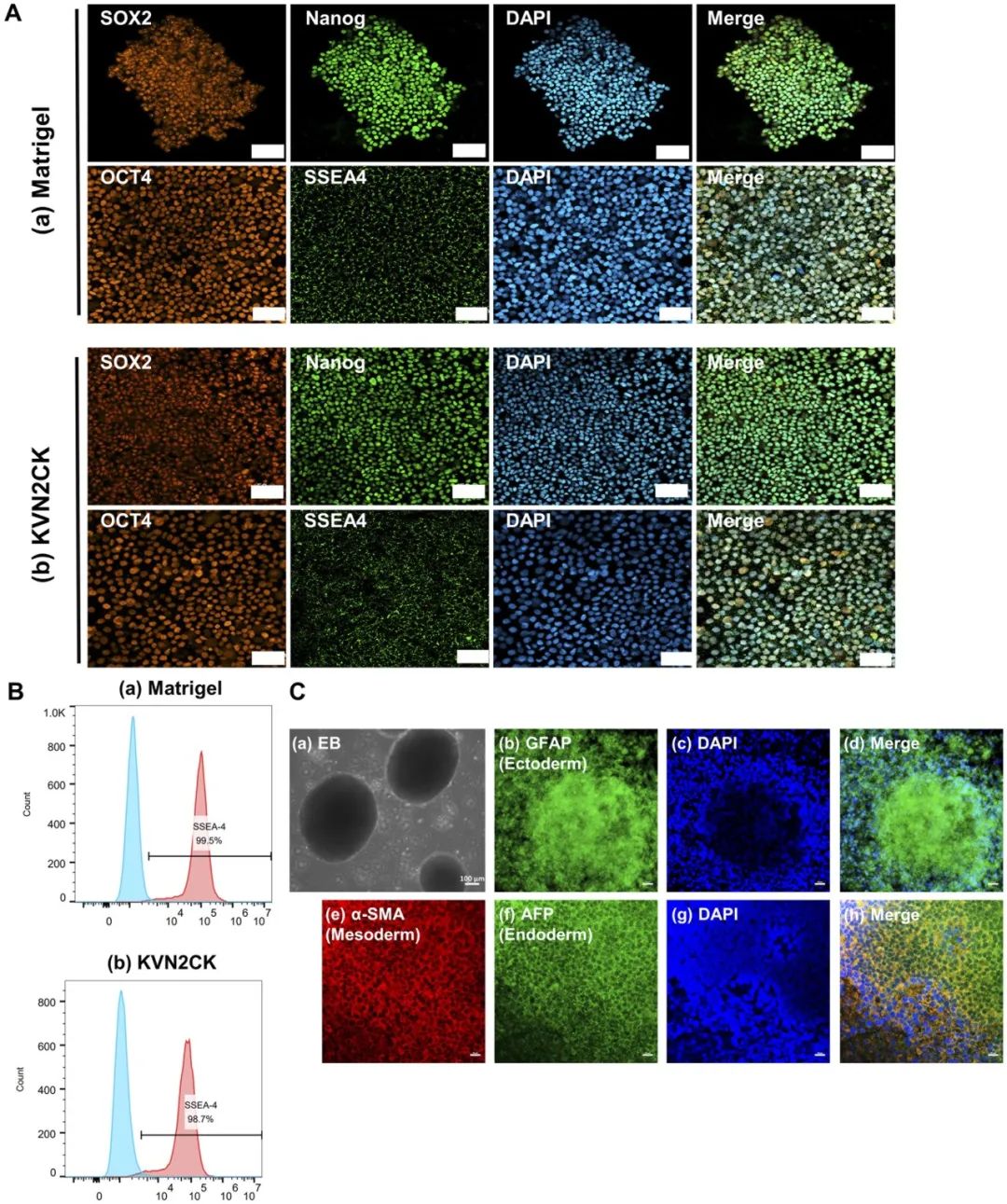
对修饰了设计肽的PAI水凝胶表面进行了X射线光电子能谱(XPS)分析,以确认肽是否成功接枝到PAI水凝胶上。评估了修饰每种肽的PAI水凝胶表面的氮碳原子比(N/C)(图2A和B)和硫碳原子比(S/C)(图2C和D)。修饰了肽的PAI水凝胶表面的N/C比显著高于未修饰肽的PAI水凝胶和TCP培养皿。与未修饰肽的PAI水凝胶和TCP培养皿相比,修饰了肽的PAI水凝胶表面也观察到类似的高S/C比趋势。由于PAI水凝胶本身不含氮或硫原子,增加的N1s含量表明肽成功接枝到了PAI水凝胶表面(图2B),而增加的S2p含量则表明肽中的半胱氨酸成功接枝(本研究所用肽含有半胱氨酸)(图2D)。 图2 肽修饰PAI水凝胶表面的物理性质。(A)通过XPS测定的、在1000 μg/mL肽浓度下制备的不同肽修饰PAI水凝胶表面的N含量。(B)肽修饰PAI水凝胶表面、未修饰肽的PAI水凝胶表面和TCP表面的N/C。(C)通过XPS测定的、在1000 μg/mL肽浓度下制备的不同肽修饰PAI水凝胶表面的S含量。(D)肽修饰水凝胶表面、未修饰肽的PAI水凝胶表面和TCP表面的S/C。(E,F)TCP表面、未修饰肽的PAI水凝胶表面以及用不同浓度KVN2CK制备的肽修饰PAI水凝胶表面上的水滴图像(E)和水接触角(F)。 材料表面的亲水性影响细胞的粘附、增殖和生物相容性。因此,我们评估了用不同肽浓度(100、200、500、1000和1500 μg/mL)制备的KVN2CK修饰PAI水凝胶的水接触角,以评价其亲水性。结果表明,即使在低至100 μg/mL的肽浓度下,水凝胶表面的亲水性也显著增加,并且在100至1500 μg/mL的肽浓度范围内,KVN2CK修饰的PAI水凝胶的水接触角不具有浓度依赖性(图2E和F)。 (二)用于hiPSC培养的肽修饰水凝胶的最佳肽类型及浓度 将hiPSC细胞系HPS0077培养在修饰了四种不同肽(VN2CK,KVN2CK,LB2CK和KLB2CK)和两种肽混合物(LB2CK/VN2CK(1:1)和KLB2CK/KVN2CK(1:1))的PAI水凝胶表面上,并采用不同的肽浓度进行实验。这些实验旨在评估肽修饰PAI水凝胶表面支持hiPSC长期自我更新的能力。制备了肽浓度为100、200、500、1000和1500 μg/mL的水凝胶表面,以研究hiPSC培养的最佳肽浓度。如图3A和补充图S1A所示,用低肽浓度(例如100 μg/mL)制备的LB2CK-和LB2CK/VN2CK-修饰的PAI水凝胶无法支持hiPSC粘附。虽然KLB2CK修饰的PAI水凝胶表面能支持hiPSC粘附,但在细胞接种5天后,水凝胶表面发现了边缘粗糙的hiPSC集落(补充图S1B)。值得注意的是,hiPSC能在用低肽浓度(如100 μg/mL)制备的VN2CK-、KLB2CK-和KVN2CK-修饰的PAI水凝胶上增殖。 图3 hiPSCs(HPS0077)在不同肽修饰PAI水凝胶表面的粘附与存活。(A)在多种肽浓度制备的肽修饰PAI水凝胶表面生长5天后收获的细胞数量。(B)hiPSCs在基质胶包被表面(a)和1000 μg/mL肽浓度制备的肽修饰PAI水凝胶表面(b-g)上生长5天的显微图像。(C)hiPSCs在基质胶包被表面和几种1000 μg/mL肽浓度制备的肽修饰PAI水凝胶表面上的扩增倍数。(D)hiPSCs在基质胶包被表面和几种1000 μg/mL肽浓度制备的肽修饰PAI水凝胶表面上培养的倍增时间。 在用1000 μg/mL肽制备的VN2CK-、KLB2CK-和KVN2CK-修饰PAI水凝胶上培养的hiPSCs表现出良好的集落形态;这些细胞显示出集落形成所需的典型未分化形态,形成了边界清晰、结构致密的集落,并具有高核质比,这与基质胶对照组相当(图3B)。这些发现表明,用1000 μg/mL肽制备的肽修饰PAI水凝胶是支持在无异源培养条件下hiPSC粘附和扩增的最佳细胞培养生物材料。 为了量化在用1000 μg/mL肽制备的肽修饰PAI水凝胶表面培养的hiPSC的生长效率,计算了培养5天后hiPSC在六种不同肽修饰水凝胶表面和一种基质胶包被表面的倍增时间(图3C)和扩增倍数(图3D)。在修饰了来源于玻连蛋白的肽(VN2CK:9.4倍,KVN2CK:10.7倍)的水凝胶表面上的细胞扩增程度大于修饰了来源于层粘连蛋白β4链的肽(LB2CK:4.4倍,KLB2CK:7.5倍)的表面。这些数据表明,序列中第一个氨基酸为赖氨酸的肽修饰水凝胶表面,其细胞扩增效率优于修饰的第一个氨基酸不是赖氨酸的肽的PAI水凝胶表面(图3C和D)。这一结果可归因于肽序列N端赖氨酸的存在,它提供了两个氨基,能够灵活地与PAI水凝胶的羧基连接。此外,最佳肽类型KVN2CK表现出的扩增倍数和倍增时间与基质胶表面相当(P<0.05)(图3C和D)。在KVN2CK修饰的PAI水凝胶上传代培养5代后存在的hiPSCs(HPS0077)数量也显示在补充图S1C中,结果表明hiPSC可以在KVN2CK修饰的PAI水凝胶上成功长期培养。 (三)在最佳肽及浓度修饰的PAI水凝胶上培养的hiPSCs表征 hiPSCs有分化成三个胚层来源细胞的潜能。维持hiPSCs的多能性是评估新型hiPSC培养表面的关键标准。蛋白标志物的特异性表达可用于识别细胞的特定生理功能,并可作为鉴定不同细胞类型的标志物。在hiPSCs于每种肽修饰的PAI水凝胶上培养5天后,通过免疫组织化学染色评估了hiPSCs上多能性标志物OCT-4、SOX2、SSEA-4和NANOG的表达(图4A和补充图S1D)。即使在肽修饰的PAI水凝胶上培养后,hiPSCs仍高度表达多能性标志蛋白。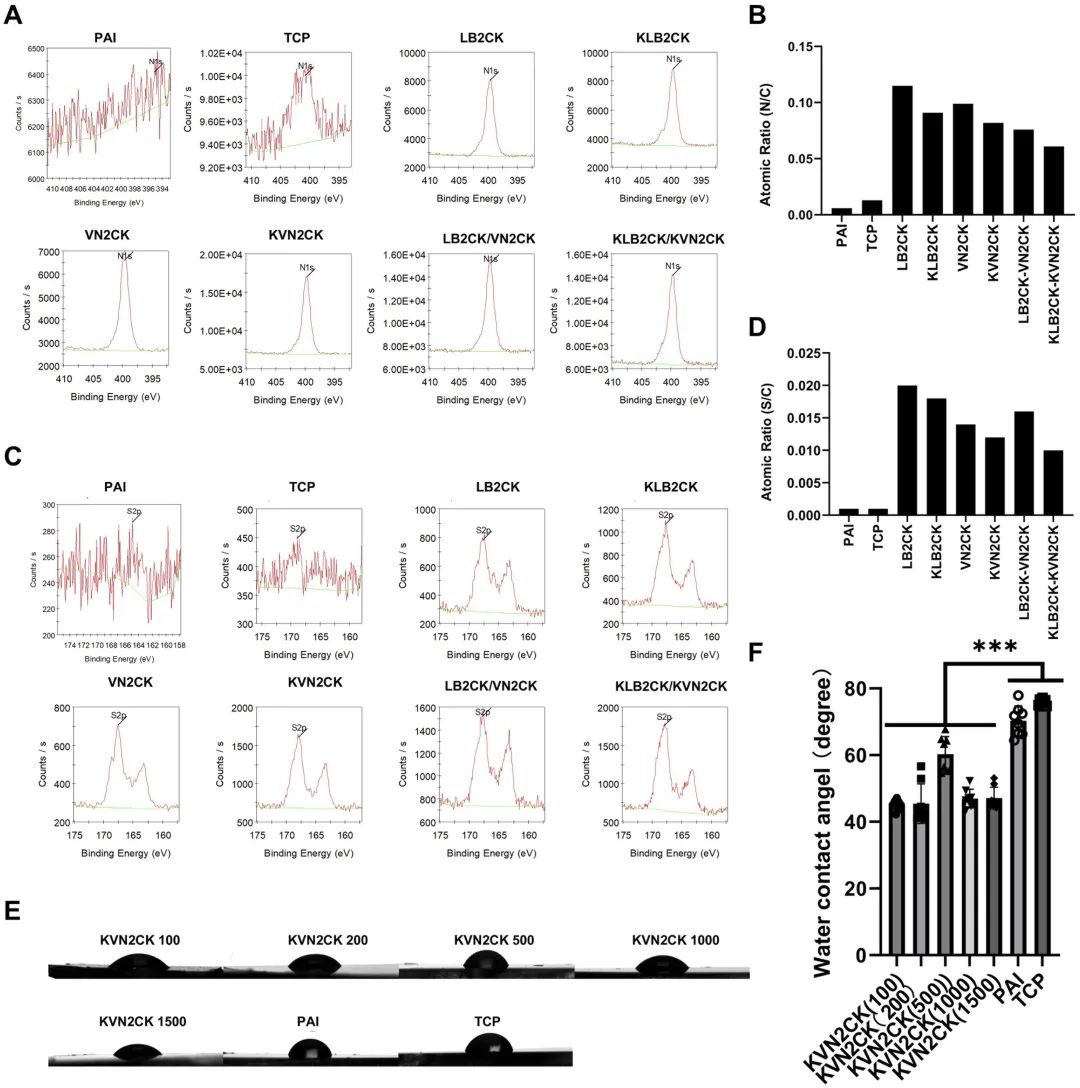
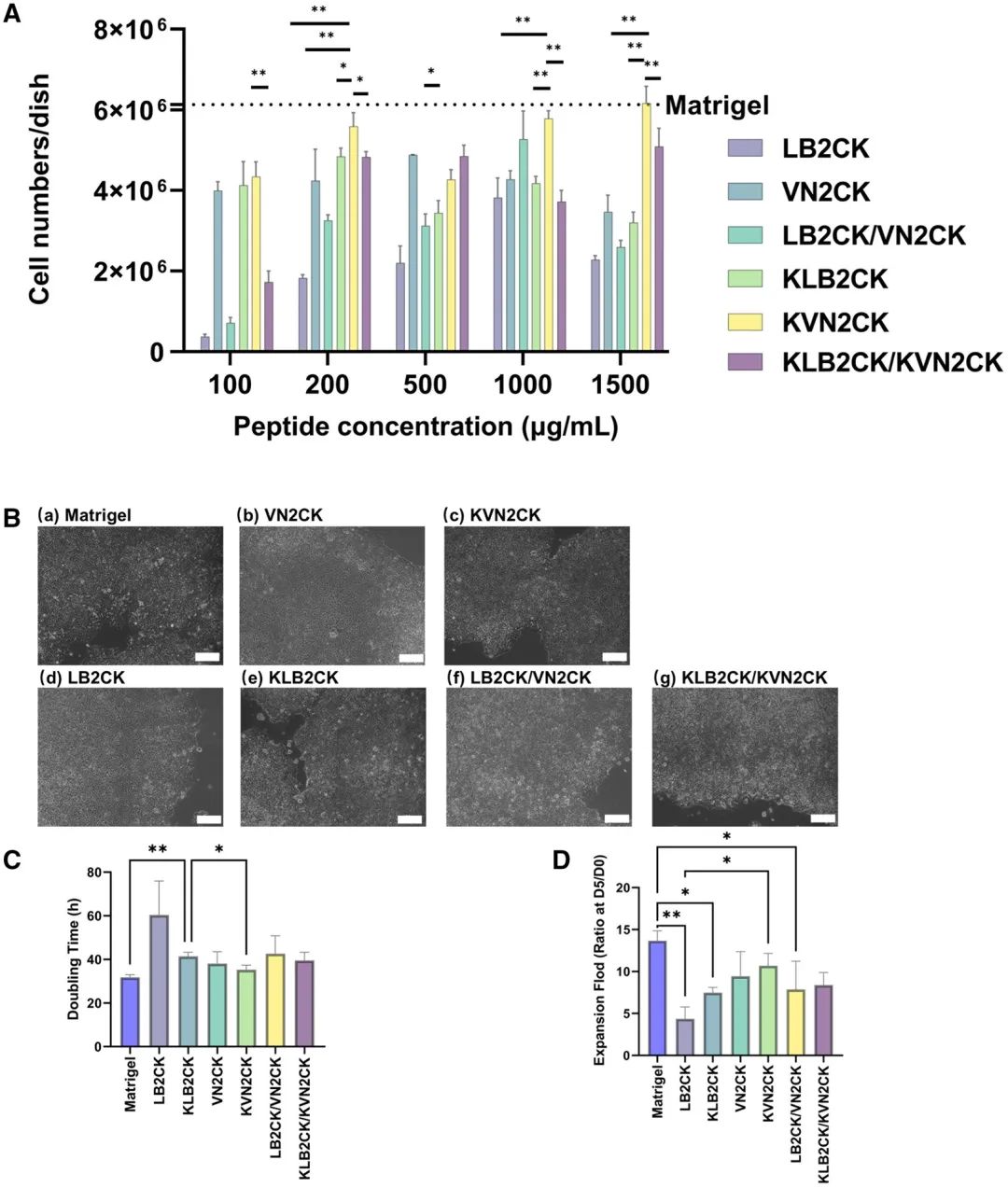
图4 在肽修饰PAI水凝胶表面培养的hiPSCs(HPS0077)的多能性及分化能力评估。(A)在(a)基质胶包被表面和(b)1000 μg/mL肽浓度制备的KVN2CK修饰PAI水凝胶表面培养5天的hiPSCs中,多能性生物标志物SOX2(红色)、NANOG(绿色)、OCT4(红色)和SSEA-4(绿色)的免疫组织化学染色。DAPI染色显示细胞核(蓝色)。(B)流式细胞术直方图显示在(a)基质胶包被表面和(b)1000 μg/mL肽浓度制备的KVN2CK修饰PAI水凝胶表面培养5天的hiPSCs中多能性标志物SSEA-4的表达。(C)(a)hiPSCs分化形成的EBs代表性图像;(b-h)来源于在1000 μg/mL肽浓度制备的KVN2CK修饰PAI水凝胶表面培养的hiPSCs的EBs免疫荧光图像。 在hiPSCs于用1000 μg/mL KVN2CK制备的KVN2CK修饰PAI水凝胶或基质胶包被培养皿(对照实验)上培养5天后,还通过流式细胞术评估了hiPSCs上多能性标志物SSEA-4、OCT4、SOX2和NANOG的表达,结果如图4B和补充图S2所示。在KVN2CK修饰的PAI水凝胶和基质胶包被培养皿上培养后,分别有98.7%和99.5%的hiPSCs表达SSEA4(图4B)。此外,在KVN2CK修饰的PAI水凝胶和基质胶包被培养皿上培养后,分别有超过95%和91%的hiPSCs表达OCT4、SOX2或NANOG(补充图S2)。这些数据表明,即使在KVN2CK修饰的PAI水凝胶上培养后,hiPSCs仍维持高水平的多能性标志物表达。 重要的是,hiPSCs具有分化成三个胚层来源细胞的能力,并能发育成体内的任何细胞类型。本研究采用拟胚体(EB)形成法评估了在KVN2CK水凝胶表面培养的hiPSCs(HPS0077)在体外的分化能力,结果如图4C所示。通过免疫荧光检测法检测到了外胚层(GFAP;胶质纤维酸性蛋白)、中胚层(α-SMA;α-平滑肌辅肌动蛋白)和内胚层(AFP;甲胎蛋白)的分化标志物(图4C)。 (四)肽修饰PAI水凝胶表面支持hiPSCs向RPE细胞的分化 本研究的目标是在无异源细胞培养条件下,在合成肽修饰的PAI水凝胶上实现GMP级hiPSC来源RPE细胞的大规模生产。我们选择了NIC分化方案用于将hiPSCs(HPS0077和MIX2)分化为RPE细胞(图5A);该方案主要基于Maruotti等开发的改进方案。NIC分化方案包括在分化第一天,将在mTeSR1培养基中培养的多能hiPSCs转变为明确培养基(DM)。在初次尝试诱导hiPSC分化为RPE细胞时,根据原始分化方案,从分化第2天到第14天使用了50 nM的CTM。然而,在本研究中,这些条件导致了细胞死亡显著增加。这可归因于不同hiPSC细胞系对不同CTM浓度的耐受性差异。因此,在本研究中,我们将NIC方案中的CTM浓度从50 nM降低至20 nM。 图5 hiPSCs(HPS0077)通过NIC84分化方案分化为RPE细胞。(A)NIC84分化方案时间线。(B)在肽浓度为1000 µg/mL制备的几种肽修饰PAI水凝胶表面分化的hiPSCs,诱导分化为RPE细胞28天后的图像。(C)在肽浓度为1000 µg/mL制备的几种肽修饰PAI水凝胶表面分化的hiPSCs,诱导分化为RPE细胞28天后的显微照片。 在LB2CK修饰的PAI水凝胶表面分化的hiPSCs(HPS0077)大部分细胞发生脱落,并且在分化第28天,在VN2CK-和LB2CK/VN2CK-修饰的PAI水凝胶表面观察到极少的细胞粘附。此外,在肽N端具有KGG的肽修饰PAI水凝胶表面保留的细胞面积,大于在肽N端不具有KGG的肽修饰PAI水凝胶表面的细胞面积(图5B)。每种肽修饰PAI水凝胶拍摄的显微照片也证明了这一现象(图5C)。支持相对稳固粘附的水凝胶(如KVN2CK、KLB2CK/KVN2CK)在分化过程中维持了部分汇合的RPE单层,细胞边缘卷起较少。而具有次优粘附特性的水凝胶(如LB2CK)则表现出近乎完全的细胞脱落。我们推测,在N端插入带正电荷的赖氨酸(K)残基的肽表现出增强的细胞粘附能力,这有助于在向RPE细胞分化过程中的长期细胞粘附。 在分化第42天,对基质胶和KVN2CK修饰PAI水凝胶表面分化细胞的显微观察显示,存在显著增加的色素细胞数量(补充图S3A),并且随着分化时间的延长,色素细胞面积也随之增加。在分化后期,仅在KVN2CK修饰的PAI水凝胶表面和基质胶包被培养皿表面观察到通过hiPSC(HPS0077)分化产生的色素细胞(补充图S3B)。相比之下,在KLB2CK-和KLB2CK/KVN2CK-修饰的PAI水凝胶上已分化为RPE细胞的细胞则表现出完全从表面脱落(补充图S3B)。 我们还使用另一个hiPSC细胞系MIX2进行了RPE细胞分化实验,以证明在KVN2CK修饰PAI水凝胶表面hiPSC向RPE细胞分化的可重复性。值得注意的是,42天后,MIX2细胞产生的色素斑点(指示RPE细胞)比HPS0077细胞更多(补充图S3A),尽管到56天时,从MIX2细胞分化来的细胞色素沉着程度与从HPS0077细胞分化来的细胞相当(图6A)。我们推测,MIX2细胞(来源于羊水干细胞(胎儿干细胞))表现出更高的细胞活力,并且更易于分化为RPE细胞。这可能是因为MIX2细胞是相对“年轻”的hiPSCs(传代数约为30-40代),而HPS0077细胞则较“老”(传代数超过100代)。在MIX2分化至第84天,通过手动去除未色素细胞以进行传代和扩增后,在KVN2CK修饰的PAI水凝胶上观察到了大量六边形的视网膜色素上皮细胞(图6B)。 图6 两株hiPSCs(HPS0077和MIX2)在KVN2CK修饰的PAI水凝胶表面和基质胶包被表面通过NIC84方案分化为RPE细胞。(A)在基质胶包被表面(a,c)和以肽浓度1000 µg/mL制备的KVN2CK修饰PAI水凝胶表面(b,d)上培养56天后,从HPS0077(a,b)和MIX2(c,d)hiPSCs分化出的RPE细胞中的色素细胞照片。(B)hiPSC来源的RPE细胞的显微镜图像:(a)在以肽浓度1000 µg/mL制备的KVN2CK修饰PAI水凝胶表面培养84天后形成的多边形色素细胞的形态;(b)(a)图中区域的放大图像;(c)从hiPSC来源的RPE细胞中收集的成熟色素细胞照片。(C)对在基质胶包被表面(a,c)和以肽浓度1000 µg/mL制备的KVN2CK修饰PAI水凝胶表面(b,d)上培养的、源自HPS0077(a,b)和MIX2(c,d)hiPSCs的RPE细胞进行RPE特异性蛋白RPE65表达的流式细胞术分析。(D)在以肽浓度1000 µg/mL制备的KVN2CK修饰水凝胶表面分化培养84天后,源自HPS0077 hiPSCs的RPE细胞的核型分析。 对在KVN2CK修饰PAI水凝胶表面和基质胶包被培养皿上培养的HPS0077来源及MIX2来源的RPE细胞进行了免疫组织化学染色,并使用以下标志物评估RPE细胞:PAX6、ZO-1、RPE65和MITF(图7)。在KVN2CK修饰的PAI水凝胶和基质胶包被培养皿上培养后,来源于HPS0077和MIX2 hiPSCs的RPE细胞均高度表达PAX6、ZO-1、RPE65和MITF(图7A)。图7B显示了通过共聚焦激光显微镜评估的hiPSC来源RPE细胞的横截面,该图像摄自图7A中测量的位置。在图7B中可以清晰地看到hiPSC来源RPE单层细胞的顶侧和基底侧。 图7 分化第84天时,源自HPS0077和MIX2 hiPSCs的RPE细胞的免疫组织化学图像。(A)在基质胶包被表面和以肽浓度1000 µg/mL制备的KVN2CK修饰PAI水凝胶表面上培养时,源自hiPSCs(HPS0077和MIX2)的RPE细胞中PAX6(绿色)、ZO-1(红色)、MITF(绿色)和RPE65(红色)的表达。(B)源自hiPSCs(HPS0077和MIX2)的RPE细胞的免疫组织化学图像截面图,该截面图评估的是与(A)图所分析样品相同位置。 基于与视觉周期功能相关的RPE65的表达,通过流式细胞术评估了hiPSC来源RPE细胞的纯度。来源于两个hiPSC细胞系(HPS0077和MIX2)的细胞均呈现RPE65的高表达,在KVN2CK修饰的PAI水凝胶和基质胶包被培养皿上培养的细胞中,超过90%的细胞表达RPE65。特别是,在KVN2CK修饰PAI水凝胶表面培养的MIX2细胞来源的RPE细胞表现出高RPE65表达(95.4%)(图6C)。这些发现支持了以下假设:KVN2CK修饰的PAI水凝胶是优异的无异源细胞培养生物材料,可成功地将hiPSCs分化为成熟的RPE细胞,从而为后续实验中视网膜下移植到RCS大鼠提供了hiPSC来源RPE细胞的细胞来源。 此外,从KVN2CK修饰PAI水凝胶表面收获的hiPSC来源RPE细胞,在KVN2CK修饰的水凝胶表面传代十次后仍保持其核型完整性(图6D),并且在HPS0077来源的RPE细胞(图6D)和MIX2来源的RPE细胞(补充图S4)中都观察到了这一模式,表明KVN2CK修饰的PAI水凝胶表面支持hiPSC来源RPE细胞的长期体外培养,且无基因改变。 还评估了在KVN2CK修饰PAI水凝胶表面和基质胶包被培养皿上培养的HPS0077来源RPE细胞分泌几种生长因子(VEGF和PEDF)的情况。在更换培养基两天后,从汇合的细胞样本中收集每种细胞条件的培养上清,使用ELISA估算这些生长因子的分泌量。所有hiPSC来源的RPE细胞都分泌人VEGF和PEDF,但在KVN2CK修饰PAI水凝胶表面和基质胶包被培养皿上培养的hiPSCs(HPS0077)之间,其分泌程度几乎相同(补充图S5)。这些生长因子的分泌量与我们既往工作报道的量接近。这些结果表明,在本研究中,任何在KVN2CK修饰PAI水凝胶表面和基质胶包被培养皿上培养的hiPSC来源RPE细胞均显示出健康的RPE细胞功能。 (五)在KVN2CK修饰水凝胶上培养的hiPSC来源RPE细胞体内功能验证 将在KVN2CK修饰PAI水凝胶表面或基质胶包被培养皿表面通过分化产生的、来源于HPS0077细胞和MIX2细胞的hiPSC来源RPE细胞,移植到视网膜变性模型大鼠(RCS大鼠)的视网膜下腔。评估RCS大鼠的视觉功能改善情况,以评估在肽修饰水凝胶表面分化的hiPSC来源RPE细胞的效果,并与先前报道的在基质胶包被培养皿表面分化的hiPSC来源RPE细胞进行比较。 RCS大鼠因其Mertk基因突变导致RPE细胞吞噬功能障碍,常被用作视网膜变性动物模型,并已用于RPE细胞移植研究。hiPSC来源RPE细胞用CellTracker™ CM-DiI染料标记,并悬浮于2 μL PBS中,浓度为5×104细胞/μL,用于移植。RCS大鼠的光感受器细胞凋亡始于出生后第三周,到2-3个月大时,绝大多数光感受器细胞发生凋亡。因此,在光感受器细胞凋亡早期(出生后21天),将四种不同类型的hiPSC来源RPE细胞(分别来源于HPS0077细胞和MIX2细胞,每种细胞均在KVN2CK修饰PAI水凝胶和基质胶包被培养皿上分化而来)移植到RCS大鼠右眼的视网膜下腔(每种条件五只RCS大鼠),形成实验组。对照组为在右眼视网膜下腔注射等体积PBS的RCS大鼠。 进行眼底照相以观察RCS大鼠移植部位的眼底,并评估手术过程中移植的hiPSC来源RPE细胞的质量。用CellTracker™ CM-DiI染料染色后移植的hiPSC来源RPE细胞组,在眼底照相中显示视网膜显著隆起,且隆起的视网膜下部位可见绿色荧光(图8)。相比之下,仅注射PBS的假手术组视网膜明显隆起,但未检测到绿色荧光。此外,本研究期间未观察到肿瘤形成或异常细胞增殖的证据。 图8 细胞疗法后RCS大鼠视觉功能评估。 视动反应(OMR)评分的定义是RCS大鼠身体/头部运动与系统周围屏幕上运动之间一致性与不一致性的比率。设定1.0作为感知觉的阈值。OMR评分低于1.0的动物被认为无法在所研究的空间频率下感知刺激。补充图S6显示了在KVN2CK修饰PAI水凝胶和基质胶包被培养皿上分化的hiPSC来源RPE细胞进行视网膜下移植后第四周,RCS大鼠的OMR评分。视网膜下移植4周后,由于装置中央平台面积较小,RCS大鼠无法在正常位置站立。因此,本研究未能获得移植后期(视网膜下移植4周后)的OMR评分。在注射后4周收集并记录了接受细胞移植的RCS大鼠的OMR评分(补充图S6A)。接受移植细胞的大鼠在0.1和0.2 c/g频率下的OMR评分(>1.0)高于假手术组大鼠(补充图S6B和C)。与这些发现一致,多项研究报道,在视网膜下移植hPSC来源RPE细胞后,大鼠在0.1–0.2 c/g范围内观察到显著的OMR反应。然而,本研究中细胞移植组与假手术组之间未发现显著统计学差异(P>0.05)。 使用视网膜电图(ERG)评估RCS大鼠的视觉功能,以进一步研究在KVN2CK修饰PAI水凝胶和基质胶包被培养皿上培养的hiPSC来源RPE细胞进行视网膜下移植后的效果(图9A和B)。ERG结果表明,与未注射的对照组大鼠相比,接受在KVN2CK修饰PAI水凝胶和基质胶包被培养皿上培养的hiPSC来源RPE细胞移植的RCS大鼠,在注射后暗视刺激强度3.0和10.0 cds/m2下呈现ERG反应(图9A)。尽管如此,在注射后4周,细胞移植组与注射PBS的假手术组之间的b波振幅差异无统计学意义(P>0.05)。接受四种不同来源hiPSC来源RPE细胞的RCS大鼠的ERG反应模式相似(P<0.05)。在注射后8周,假手术组的b波振幅显著减小(图9B),而在移植了来源于在KVN2CK修饰PAI水凝胶和基质胶包被培养皿上培养的HPS0077和MIX2 hiPSCs的RPE细胞的RCS大鼠中观察到强烈的ERG反应,这表明即使在后期(注射后8周),RPE细胞移植也能恢复RCS大鼠的视觉功能(P<0.05)。 图9 视网膜下移植hiPSC来源的RPE细胞对RCS大鼠疗效评估。(A,B)RCS大鼠在暗适应条件下,于视网膜下移植RPE细胞后4周(A)和8周(B)的b波振幅。(C)RCS大鼠移植后8周视网膜切片的代表性HE染色图像:(a)移植PBS的视网膜;(b,c)移植HPS0077来源RPE细胞的视网膜,该细胞培养于以肽浓度1000 µg/mL制备的KVN2CK修饰PAI水凝胶表面(b)和基质胶包被表面(c);(d,e)移植MIX2来源RPE细胞的视网膜,该细胞培养于以肽浓度1000 µg/mL制备的KVN2CK修饰PAI水凝胶表面(d)和基质胶包被表面(e)。(D)移植后8周,在RCS大鼠视网膜上选取14个点统计的ONL细胞核层数。(E)移植后8周,RCS大鼠视网膜ONL厚度。 我们的研究结果表明,在本研究中,PBS注射在初始阶段(注射后4周)对恢复RCS大鼠的视觉功能表现出一定程度的有效性,但在后期(注射后8周)无效。这种效应可能归因于视网膜下注射能够刺激RPE或其他细胞释放调节视网膜新生血管形成和炎症的生长因子。 光感受器细胞的胞体位于视网膜的外核层(ONL)内。ONL厚度的增加表明光感受器细胞数量增多。在注射后8周,摘取RCS大鼠眼球用于对不同来源hiPSC来源RPE细胞移植的组织学评估(图9C)。本研究计算了ONL的视网膜厚度和ONL内每柱的细胞核数量。每个切片选择14个位置进行测量,每个点距离视神经乳头(ONH)200 μm间隔。按照我们既往研究建立的方法,评估并分析了每个点的ONL视网膜厚度以及所有14个点的平均ONL视网膜厚度。细胞治疗组的ONL厚度显著大于PBS假手术组。在假手术组大鼠眼中观察到ONL厚度减少和ONL内核层数量减少,而接受hiPSC来源RPE细胞移植的大鼠视网膜则显示出ONL厚度的维持(图9D)。我们在移植眼中观察到的ONL厚度提示光感受器的保存,但由于本研究的局限性(未报告移植RPE与宿主细胞整合的完整证据),可能略有高估。在KVN2CK修饰PAI水凝胶和基质胶包被培养皿上培养后移植hiPSC来源RPE细胞的大鼠视网膜,其ONL厚度比假手术组更厚(图9E)(P<0.05),这证实了在无异源培养条件下于KVN2CK修饰PAI水凝胶表面分化的hiPSC来源RPE细胞,在移植后对维持视网膜结构具有有益作用。 对移植了在KVN2CK修饰PAI水凝胶表面培养的hiPSC来源RPE细胞的视网膜切片,也进行了人细胞核和RPE65抗体的染色(补充图S7)。我们观察到,即使在hiPSC来源RPE细胞视网膜下移植8周后,仍可见微弱的人细胞核和人RPE细胞免疫染色。这些结果表明,一些移植到视网膜下的hiPSC来源RPE细胞在注射后8周仍能存活。这些结果表明,本研究中RCS大鼠移植hiPSC来源RPE细胞后的视觉功能改善可能是基于移植的hiPSC来源RPE细胞。 三、讨论 迄今为止,一系列无异源hPSC培养基底,包括人重组ECM蛋白及其片段,已被应用于临床。然而,对于基于干细胞疗法的再生医学治疗而言,仍需进一步优化hPSC培养基底。此优化过程应包括建立稳定的培养条件、良好的灭菌性能、减少实验批次间的差异以及降低生产成本,以获得高质量且无污染的hPSC来源细胞。因此,我们设计了一种人工合成的、成分明确的干细胞培养基底——肽修饰PAI水凝胶。它能够促进hiPSC的粘附、自我更新和向特定细胞谱系的分化,可作为重组ECM蛋白包被培养皿的替代品。本研究的一个目标是促进未来用于临床的大规模自动化干细胞生产。 本文使用的偶联肽序列在研究初期经过筛选和优化。与第一个残基不含赖氨酸的肽修饰PAI水凝胶表面相比,以赖氨酸为序列第一个氨基酸的肽修饰PAI水凝胶表面实现了更优的细胞增殖效率和hiPSC向RPE细胞的分化。这一现象可归因于赖氨酸NH2侧链增强的灵活性,这可能有助于肽链进行有效且灵活的运动,从而实现与hiPSCs上整合素受体的结合。 本研究制备的不同水凝胶表面均评估了其维持hiPSC多能性的能力。细胞培养表面的其他物理化学特性,包括弹性模量、表面粗糙度、亲水性和表面官能团,也影响干细胞的粘附和增殖。这些因素可能有助于肽修饰PAI水凝胶的进一步优化。 我们的结果表明,KVN2CK修饰的PAI水凝胶表面有利于hiPSCs向RPE细胞的分化。RPE细胞的生产需要较长时间(如84天),因此需要具有高粘附能力的细胞培养基底。hiPSC来源的RPE细胞仅在KVN2CK修饰的PAI水凝胶表面获得,该表面在本研究中表现出最高的粘附增殖能力,表明了这种细胞培养材料的潜力。与市售hiPSC细胞系HPS0077相比,MIX2细胞表现出更强的RPE分化适应性。这一观察结果可能归因于MIX2细胞是从羊水中的胎儿干细胞重编程而来,这些细胞比成体干细胞更原始,其多能性特征更接近胚胎干细胞。 我们的发现表明,PBS在注射后4周也能部分恢复RCS大鼠的视觉功能。类似地,已有报道称生理盐水注射可保护光感受器活力至少2个月,并且已证明暂时的视网膜脱离可能诱导RCS大鼠的光感受器挽救。同样,在另一种视网膜变性疾病动物模型RDS小鼠中,视网膜下注射PBS导致光感受器死亡减少,并降低了光感受器蛋白2(在RDS小鼠中发生突变)的表达。这些现象可能通过补体相关通路的激活来解释。 我们的研究主要集中于开发肽修饰水凝胶,作为基质胶包被培养皿的替代品,用于hPSC向RPE细胞分化的细胞培养材料。通常,基质胶包被培养皿用于hPSC的培养和分化。基质胶是由EHS小鼠肉瘤细胞分泌的可溶性基底膜基质,含有层粘连蛋白、巢蛋白、胶原蛋白、硫酸肝素蛋白聚糖以及生长因子(如TGF-β和EGF)。然而,基质胶的确切组成因批次而异。特别是,基质胶是异源来源的材料,且化学成分不明确,这阻碍了其作为细胞培养包被材料在临床应用中的使用。另一方面,本研究开发的肽修饰PAI水凝胶是无异源且化学成分明确的细胞培养材料,更适用于hPSC的临床培养和分化。这些水凝胶提供了一个明确且可调节的微环境,支持RPE的成熟。然而,出于移植目的,必须考虑几个额外因素,包括机械稳定性、与宿主组织的整合、FDA批准以及体内功能表现。作为本研究的一个局限,我们未来工作需要继续评估在肽修饰PAI水凝胶上培养的hiPSC来源RPE细胞,包括使用跨上皮电阻(TER)、吞噬活性测定以及透射电镜(TEM)黑色素颗粒测定,并在RCS大鼠中进行hiPSC来源RPE细胞的长期(超过8周)移植分析。 文献中已探索了不同的RPE移植方法,包括细胞悬液、支架上的细胞单层和生物工程细胞片。虽然肽修饰水凝胶可能支持单层形成并增强RPE分化,但需要进一步修饰以确保水凝胶满足移植的机械和生化要求。例如,交联策略或混合支架设计可以改善基于水凝胶的RPE细胞片的结构完整性和操作性能。 当前干细胞疗法面临的一个挑战是分化的hiPSC来源RPE细胞纯度低。本研究通过人工将色素细胞与非色素细胞分离,这可能导致细胞浪费和纯化不完全。目前用于选择特定细胞的纯化方法包括人工法、酶解法和基于流式细胞术的分选。开发一种新颖、简化的纯化方法对于未来hPSC分化细胞的临床应用至关重要。 课题组简介 通讯作者 Akon Higuchi,温州医科大学教授。日本东京工业大学获博士学位,先后在日本成蹊大学、台湾地区中央大学任教授。长期从事开发生物医学材料、干细胞培养及分化的研究,目前担任英国皇家化学会士、美国医学与生物工程院会士、台湾地区化学工程协会会士、Riken客座研究员。2018年引进温州医科大学、附属眼视光医院。担任国际组织工程与再生医学学会亚太分会委员,国际学术期刊Open Physics主编、Royal Society of Chemistry编委、Laboratory Investigation编委。以第一作者或通讯作者共发表SCI论文270余篇(单篇最高IF=72.1),H指数60,发明专利11项。2021年获TERMIS-AP“杰出贡献科学家奖”(三年亚太唯一获奖者)。 * 通讯作者简介源于网络 文章信息 Jun Liu, Qian Liu, Minmei Guo, Chengyu Jiang, Jianyang Chen, Ting Wang, Tzu-Cheng Sung, Shih-Jie Chou, Shih-Hwa Chiou, Guoping Fan, Akon Higuchi*, Differentiation of human induced pluripotent stem cells into retinal pigment epithelium cells during culture on peptide-grafted hydrogels, Regenerative Biomaterials, Volume 12, 2025, rbaf035, https://doi.org/10.1093/rb/rbaf035